
テクノロジー
イオンチャネルは生理機能において基本的かつ重要な役割を果たします。また、数多くの神経系疾患や心血管系疾患、代謝性疾患、がん細胞の増殖や転移、免疫細胞の制御にも深く関わることから、極めて重要な薬物標的です。
1950年代から1980年代にかけて、イオンチャネルを標的とする薬剤が多数開発され、多くの薬剤が現在でも使用されています。しかし、そのほとんどが標的分子に対する十分な選択性を欠いており、その使用法や副作用には十分な注意が払われなければなりません。こうした課題から、標的選択性の高いイオンチャネル薬の開発は、製薬業界において非常に重要なテーマであり、これまで多くの努力が積み重ねられてきました。しかしながら、近年においても、開発されたイオンチャネル薬はオリジナルの化合物の構造に似たme too drugが多く、母核構造を基に機能や特性を少し改変したものにすぎません。新規な構造を持ち、活性と選択性の両方で優れたイオンチャネル薬の開発の成功例はわずかというのが現状です。
少し自然界の生物に目を向けてみましょう。クモやサソリ、ヘビ、イモガイなどの生物は、毒液を利用することで厳しい生存競争に打ち勝ってきました。これらの生物は、獲物となる昆虫や動物に毒液を注入し、神経を麻痺させ動けなくすることで、捕食しています。毒液には多様なペプチドやタンパク質が含まれ、それぞれが非常に高い生理活性作用を有しています。興味深いことに、毒液中のペプチドには、イオンチャネルに対して作用するものが特に多く、非常に強力な活性と比較的高い分子選択性を有しています。それらのペプチドは、分子内に複数のジスルフィド結合を有することから、ジスルフィドリッチペプチド(DRP)と呼ばれています。近年では、様々な生物の毒液からDRPが数多く発見されており、それぞれが特徴的なアミノ酸配列とイオンチャネルモジュレーターとしての機能を有することが、多くの研究者により明らかにされています。例えば、ローズヘアタランチュラの毒液中から見つかったGTx1-15は、疼痛緩和薬開発のための有望な標的分子として考えられている電位依存性ナトリウムチャネルNav1.7およびNav1.3の機能を選択的に阻害します。イソギンチャクStichodactyla helianthusの毒液から見つかったShKは電位依存性カリウムチャネル(Kv1.1, Kv1.3, Kv1.4, Kv1.6)の機能を強力に阻害します。
これらの生物由来のDRPは、強力かつ比較的高い選択性で特定のイオンチャネルの機能を制御できることから、イオンチャネル創薬のための有望なリード化合物として考えられています。このようなアイディアに基づいて、イモガイ由来のDRPであるω-conotoxinからZiconotideと呼ばれる疼痛緩和薬が実際に開発されています。ZiconotideはニューロンのN型電位感受性カルシウムチャネルを強力に阻害し、モルヒネが効かない激しい痛みに対しても効果を示します。
しかしながら、DRPを基に開発されたイオンチャネル薬はZiconotideのみです。これまで多大な期待を集めながらもDRP開発の多くは成功には至っていません。その理由として、DRPは構造が複雑で化学的な合成が極めて困難であること挙げられます。合成が困難であるがゆえに、その活性と選択性について評価できるアミノ酸置換体の数が極めて限られることから、医薬品として十分な活性と選択性を有するDRPをデザインすることがこれまで難しかったのです。
このようなDRP医薬品開発の困難さを打破するするために、当社は、従来のDRP開発手法とは一線を画した革新的なDRPスクリーニング技術Veneno Suiteを開発しました。私達はこのVeneno Suiteを活用して、これまでの医薬品の主要なモダリティである低分子化合物や抗体では不可能であった、高活性と高選択性を兼ね備えたイオンチャネル薬を開発します。
また、Veneno SuiteはGPCRやトランスポーターなどの膜タンパク質標的とした創薬にも適用可能です。我々は、これまで創薬が難しかった膜タンパク質を標的とし、様々な疾患を対象として創薬を展開します。
さらに、ゲノム情報を活用することで、ヒト以外の動物、虫、植物、細菌の膜タンパク質を標的とした機能性DRPを創製することが可能です。様々な企業とコラボレーションしながら、動物医薬品、農薬成分、機能性のバイオケミカル素材の開発にも取り組みます。
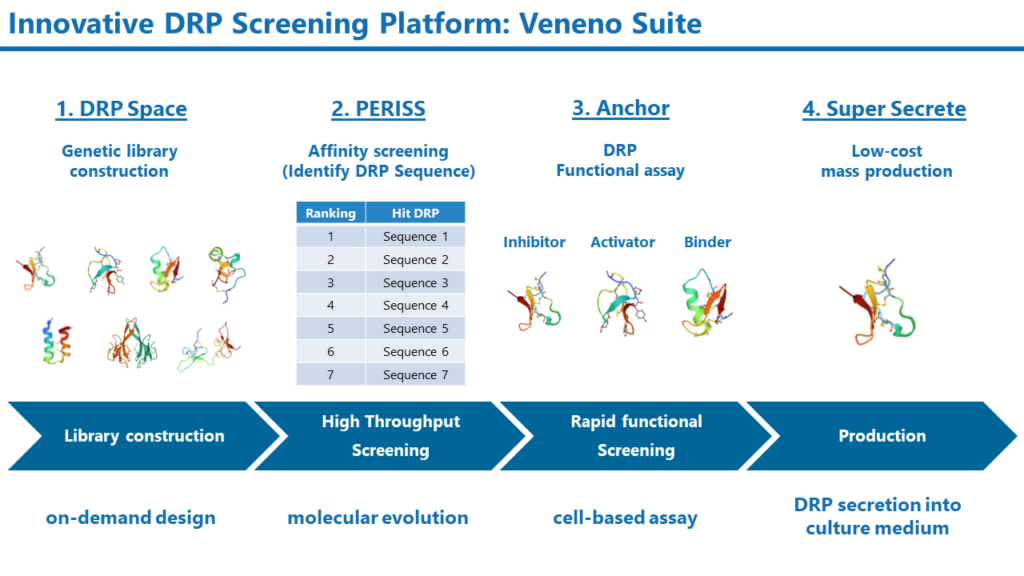
Veneno Suite
天然のDRPは動物や昆虫のイオンチャネルに対して強力に作用するように進化してきましたが、ヒトのイオンチャネルに対するモジュレーターとして最適化されているわけではありません。DRPを医薬品とするには、人工的に改変する必要があります。Veneno Suiteは、DRPのライブラリ作製からスクリーニング、生産までをサポートする新規DRP創製のためのプラットフォーム技術です。
Veneno Suiteは次の4つのコアテクノロジーから構成されます。
1. 膨大な多様性を有するDRPの遺伝子ライブラリ構築手法:DRP Space
2. 進化分子工学を活用したDRPのハイスループットスクリーニング手法:PERISS
3. DRPの活性と選択性を迅速に評価するセルベースアッセイ手法:Anchor
4. 大腸菌を活用したDRPの低コスト生産技術;Super Secrete
Veneno Suiteでは、ゲノム情報やDRPの構造および物理化学的な情報に基づいて、DRPの遺伝子ライブラリを構築します。このDRP Spaceでは、従来の化学的手法では構築不可能な、膨大な多様性を有するライブラリを構築できます。構築した遺伝子ライブラリは、進化分子工学を活用したハイスループットスクリーニング手法PERISSに投入されます。PERISS法では、10億の多様性を持つDRPライブラリ中から、標的の膜タンパク質に対して高い親和性を持つDRPが選択されます。PERISSで見いだされたDRPの活性はAnchor法で迅速にスクリーニングされます。このAnchor法では標的分子に応じたアッセイ手法が用いられます。例えば、イオンチャネルを標的とした場合には、電気生理学的な手法によりDRPの機能を同定します。Super Secrete法は大腸菌を用いたDRPの生産手法で、ペリプラズム空間で折りたたまれたDRPを培地中に分泌させることができます。この手法により、従来の化学合成法よりも安価かつ迅速に生産することが可能となります。
Disulfide-Rich Peptide (DRP)とは?
ジスルフィドリッチペプチド(DRP)は分子内に複数のジスルフィド結合を有するペプチドです。通常、20から60個のアミノ酸から構成されます。特に、クモやサソリ、ヘビなどの毒液中に含まれるDRPは、イオンチャネルやGPCRに対して、強力かつ選択的に作用することが知られています。DRPはそのジスルフィド結合が生み出す堅固なフレームワークにより、直線状ペプチドと比較して、分解酵素、酸、熱に対して高い安定性を持っています。また、コンパクトで安定な構造であるがゆえに、免疫原性が低いことが知られています。このような特性により、DRPはイオンチャネルやGPCR薬開発のための有望のリード化合物であると考えられています。

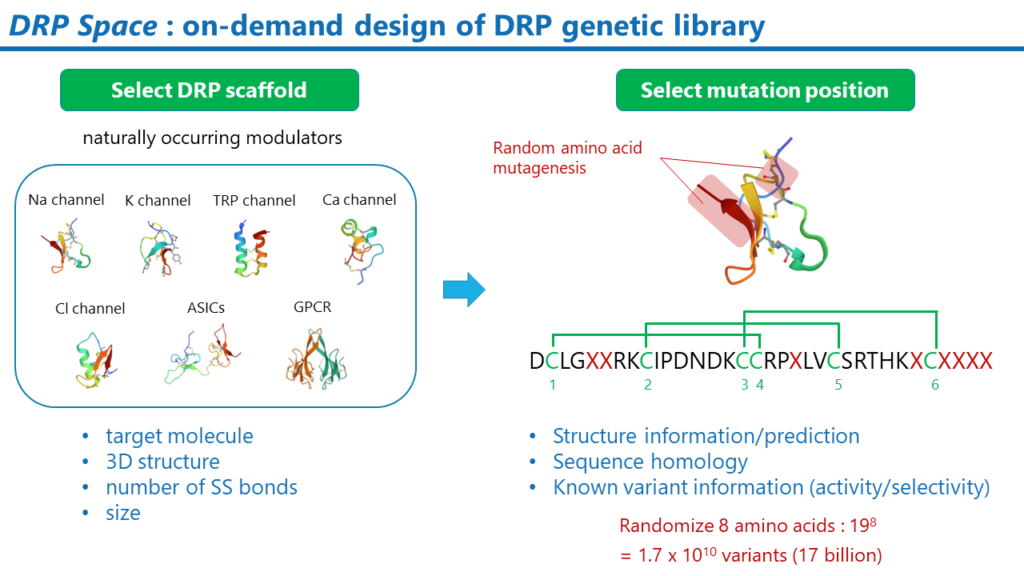
DRP Space
DRPの遺伝子ライブラリの構築手法です。DRPの遺伝子ライブラリは、標的分子に合わせて、スクリーニングのプロジェクト毎にデザインされます。目的に応じて様々な考え方を基に構築することができますが、例えば、あるナトリウムイオンチャネルを標的とする場合、天然のナトリウムイオンチャネルモジュレーターDRPを基に構築するという方法が考えられます。DRPの基本骨格を決定後は、ランダムなアミノ酸変異を導入する部位を決定します。このランダム変異を導入する部位も様々な考え方を基に決定できます。例えば、膜タンパク質と相互作用しうる部位を採用することです。これらの部位は、Membrane Docking Optimal Area法などの計算科学的な手法により推定できます。また、DRP変異体の活性および選択性に関する情報も変異導入位置を決定する上で参考になります。
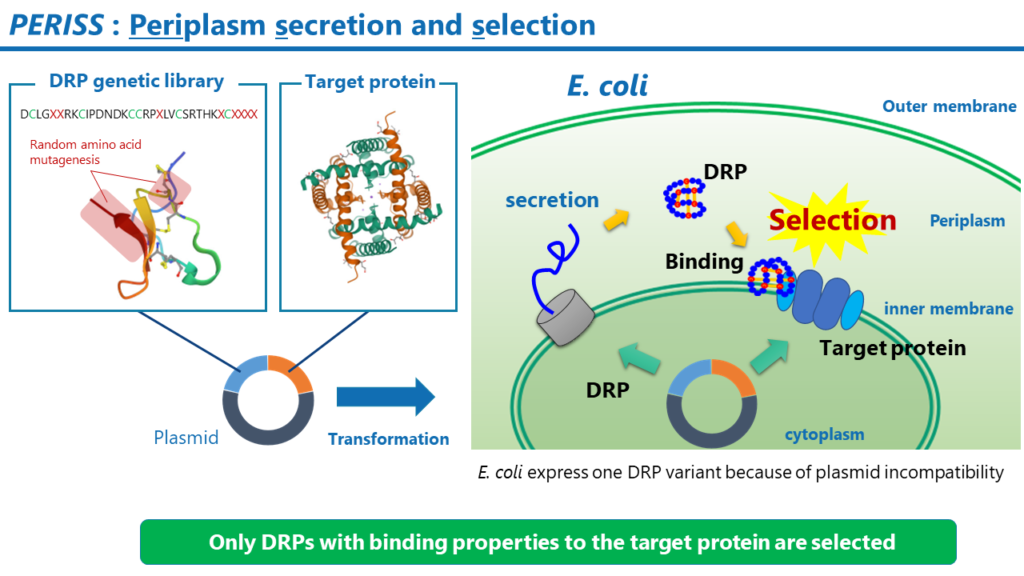
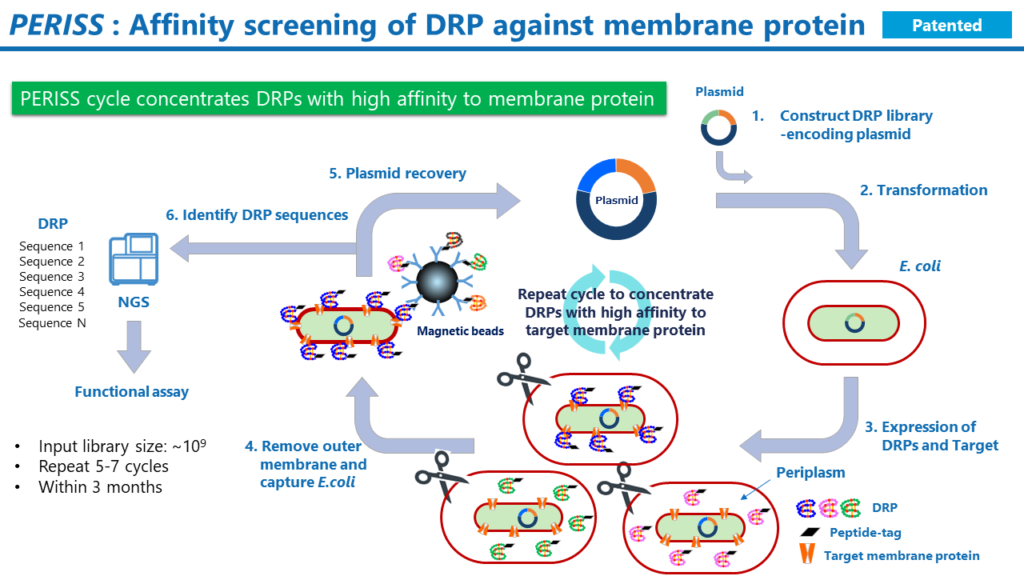
PERISS
PERISSは進化的分子工学に基づくハイスループットなスクリーニング方法です。PERISS法では、構築したライブラリ中のDRPのうち、標的の膜タンパク質に対して強く結合するDRPをコードするプラスミドが濃縮されます。PERISSで回収されたプラスミドのDRPをコードするDNA配列を次世代シーケンシング法で解析することにより、標的膜タンパク質に強く結合できるDRPのアミノ酸配列を同定することができます。
その工程は以下の通りです。
- DRPの遺伝子ライブラリと標的タンパク質をコードするプラスミドを調製します。
- 調製したプラスミドで大腸菌を形質転換します。
- 大腸菌を培養すると、大腸菌の内膜には標的タンパク質が発現します。ペリプラズム空間には、DRPが発現します。DRP中のジスルフィド結合は、ペリプラズム空間に存在する酵素群であるDsbファミリーの働きによって形成されます。プラスミド不和合性により、1つの大腸菌中では1種類のDRPの変異体が発現します。
- 大腸菌の外膜を除去し、DRPの末端に付加したタグ配列に対する抗体で標識した磁気ビーズで大腸菌のスフェロプラストを回収します。この操作により、標的膜タンパク質に結合性のDRPをコードするプラスミドを保持する大腸菌が回収されます。
- 大腸菌からプラスミドを抽出して、そのプラスミドで再び大腸菌を形質転換します。
- 上記の操作を通常5から7回繰り返すと、標的膜タンパク質に強く結合するDRPをコードするプラスミドが濃縮されます。最後に、回収したプラスミド中のDRPをコードするDNA配列を次世代シーケンサーで解析します。NGSのリード中に高頻度で出現するDRPのアミノ酸配列を複数同定します。
DRP Spaceによって構築された遺伝子ライブラリのうち、10億種類の配列がPERISSスクリーニングに投入されます。プラスミド不和合性のため、PERISS法では1つの大腸菌が1つの反応場として働き、標的膜タンパク質に対して高い親和性を持つDRP変異体が選別されます。一連の工程は3か月で完了できます。
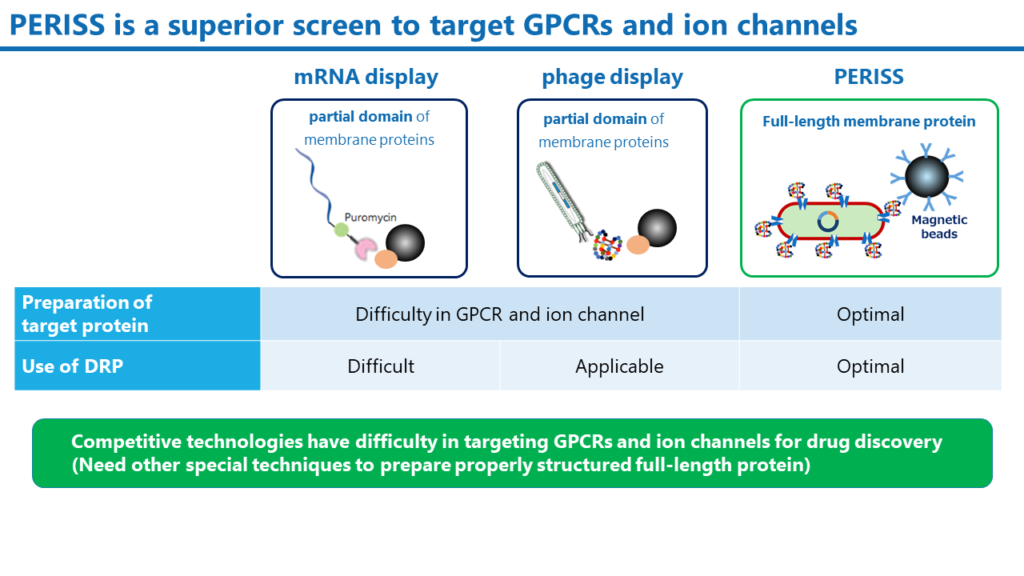
PERISS法は大腸菌のペリプラズム空間を用いる独自のテクノロジーで、細胞質で翻訳されたDRP分子はこの空間で正しくジスルフィド結合が構築されます。大腸菌の内膜上には完全長の標的膜タンパク質を発現させることが可能です。一方、mRNAディスプレイおよびファージディスプレイは、広く利用される抗体およびペプチドスクリーニング方法ですが、いずれの手法でも、完全長の膜タンパク質を脂質二重膜上に発現させるには、別途、非常に高度なテクニックが必要です。また、mRNAディスプレイではDRPのジスルフィド結合を形成させることが困難なため、DRP分子のスクリーニングには適していません。
PERISS法はイオンチャンネルにのみ特化した技術ではありません。当社では、既に、GPCRをはじめとした様々なヒトの膜貫通タンパク質を発現できることを確認しています。可溶性のタンパク質であっても、内膜上にアンカーリングさせることにより標的とすることが可能です。PERISS法は、様々なタンパク質に対して結合性のDRPを同定できる汎用性の高いスクリーニング法です。
PERISS
PERISSは進化的分子工学に基づくハイスループットなスクリーニング方法です。PERISS法では、構築したライブラリ中のDRPのうち、標的の膜タンパク質に対して強く結合するDRPをコードするプラスミドが濃縮されます。PERISSで回収されたプラスミドのDRPをコードするDNA配列を次世代シーケンシング法で解析することにより、標的膜タンパク質に強く結合できるDRPのアミノ酸配列を同定することができます。
その工程は以下の通りです。
- DRPの遺伝子ライブラリと標的タンパク質をコードするプラスミドを調製します。
- 調製したプラスミドで大腸菌を形質転換します。
- 大腸菌を培養すると、大腸菌の内膜には標的タンパク質が発現します。ペリプラズム空間には、DRPが発現します。DRP中のジスルフィド結合は、ペリプラズム空間に存在する酵素群であるDsbファミリーの働きによって形成されます。プラスミド不和合性により、1つの大腸菌中では1種類のDRPの変異体が発現します。
- 大腸菌の外膜を除去し、DRPの末端に付加したタグ配列に対する抗体で標識した磁気ビーズで大腸菌のスフェロプラストを回収します。この操作により、標的膜タンパク質に結合性のDRPをコードするプラスミドを保持する大腸菌が回収されます。
- 大腸菌からプラスミドを抽出して、そのプラスミドで再び大腸菌を形質転換します。
- 上記の操作を通常5から7回繰り返すと、標的膜タンパク質に強く結合するDRPをコードするプラスミドが濃縮されます。最後に、回収したプラスミド中のDRPをコードするDNA配列を次世代シーケンサーで解析します。NGSのリード中に高頻度で出現するDRPのアミノ酸配列を複数同定します。
DRP Spaceによって構築された遺伝子ライブラリのうち、10億種類の配列がPERISSスクリーニングに投入されます。プラスミド不和合性のため、PERISS法では1つの大腸菌が1つの反応場として働き、標的膜タンパク質に対して高い親和性を持つDRP変異体が選別されます。一連の工程は3か月で完了できます。
PERISS法は大腸菌のペリプラズム空間を用いる独自のテクノロジーで、細胞質で翻訳されたDRP分子はこの空間で正しくジスルフィド結合が構築されます。大腸菌の内膜上には完全長の標的膜タンパク質を発現させることが可能です。一方、mRNAディスプレイおよびファージディスプレイは、広く利用される抗体およびペプチドスクリーニング方法ですが、いずれの手法でも、完全長の膜タンパク質を脂質二重膜上に発現させるには、別途、非常に高度なテクニックが必要です。また、mRNAディスプレイではDRPのジスルフィド結合を形成させることが困難なため、DRP分子のスクリーニングには適していません。
PERISS法はイオンチャンネルにのみ特化した技術ではありません。当社では、既に、GPCRをはじめとした様々なヒトの膜貫通タンパク質を発現できることを確認しています。可溶性のタンパク質であっても、内膜上にアンカーリングさせることにより標的とすることが可能です。PERISS法は、様々なタンパク質に対して結合性のDRPを同定できる汎用性の高いスクリーニング法です。



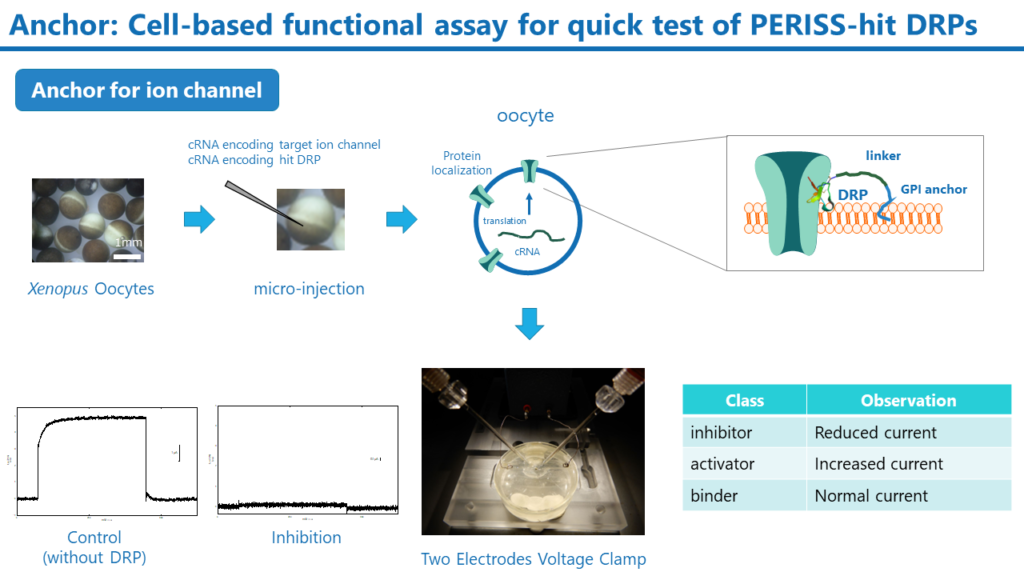
Anchor
PERISS法では標的膜タンパク質結合性のDRPが多数同定されます。これらのヒットDRPが膜タンパク質の機能を制御できるかを迅速にアッセイする手法がAnchorです。この手法では、創薬標的の膜タンパク質のcRNAとヒットDRPのcRNAを用意します。そして、両方のcRNAをアフリカツメガエルの卵母細胞にマイクロインジェクションし、膜タンパク質とDRPを卵母細胞の細胞膜上に発現させます。標的膜タンパク質がイオンチャネルの場合、二本電極電位固定法によりイオンチャネルの活性を測定することで、DRPの機能評価が可能です。
Anchor法は半定量的ではありますが、個別にDRPを調製せずとも、DRPのcRNAを用意するだけで、活性を評価できる非常に迅速な手法です。また、標的以外のイオンチャネルを発現させることで、標的選択性についても評価することができます。Anchor法で見いだされた高い活性を有するDRPは、下記に述べるSuper Secrte法で生産され、そのIC50やEC50は細胞および動物を用いた試験で詳細に解析されます。
Anchor
PERISS法では標的膜タンパク質結合性のDRPが多数同定されます。これらのヒットDRPが膜タンパク質の機能を制御できるかを迅速にアッセイする手法がAnchorです。この手法では、創薬標的の膜タンパク質のcRNAとヒットDRPのcRNAを用意します。そして、両方のcRNAをアフリカツメガエルの卵母細胞にマイクロインジェクションし、膜タンパク質とDRPを卵母細胞の細胞膜上に発現させます。標的膜タンパク質がイオンチャネルの場合、二本電極電位固定法によりイオンチャネルの活性を測定することで、DRPの機能評価が可能です。
Anchor法は半定量的ではありますが、個別にDRPを調製せずとも、DRPのcRNAを用意するだけで、活性を評価できる非常に迅速な手法です。また、標的以外のイオンチャネルを発現させることで、標的選択性についても評価することができます。Anchor法で見いだされた高い活性を有するDRPは、下記に述べるSuper Secrte法で生産され、そのIC50やEC50は細胞および動物を用いた試験で詳細に解析されます。

Super Secrete
これまで、DRPは主に化学合成法(ペプチド合成)によって生産されてきました。化学合成法では、分子内に複数あるジスルフィド結合が正しく形成されたDRPを大量に合成することは困難で、高額な製造コストを要します。この点が薬理学的評価や毒性・安全性評価をスピーディーに進める上でのDRP創薬の大きなハードルとなっていました。

当社は、DRPを大腸菌のペリプラズム空間内に発現し正しい構造にフォールディングさせた後、培養液中にDRPを分泌させる技術Super Secrete法を日本の化学会社と共同で開発しています。一般的に、大腸菌はペプチドやタンパク質を培養液中に分泌できませんが、Super Secrete法では特殊な培養液を用いることでそれを可能にします。大腸菌を破砕してペプチドやタンパク質を精製する方法では、LPSなど大腸菌由来の成分の混入を避けるために、入念な精製工程が必要です。一方、Super Secreteでは、大腸菌を破砕する必要がないため、菌体由来の成分の混入の大幅な削減と精製工程の簡略化が可能となります。当社はラボレベルの少量スケール生産法(小型のジャーファーメンターを用いた培養と精製法)を確立しています。
これにより、初期の開発ステージにおける薬理学的試験(細胞アッセイ、動物試験)、安定性、毒性・安全性試験に必要な量のDRPを提供することが可能となりました。
Super Secrete
これまで、DRPは主に化学合成法(ペプチド合成)によって生産されてきました。化学合成法では、分子内に複数あるジスルフィド結合が正しく形成されたDRPを大量に合成することは困難で、高額な製造コストを要します。この点が薬理学的評価や毒性・安全性評価をスピーディーに進める上でのDRP創薬の大きなハードルとなっていました。
当社は、DRPを大腸菌のペリプラズム空間内に発現し正しい構造にフォールディングさせた後、培養液中にDRPを分泌させる技術Super Secrete法を日本の化学会社と共同で開発しています。一般的に、大腸菌はペプチドやタンパク質を培養液中に分泌できませんが、Super Secrete法では特殊な培養液を用いることでそれを可能にします。大腸菌を破砕してペプチドやタンパク質を精製する方法では、LPSなど大腸菌由来の成分の混入を避けるために、入念な精製工程が必要です。一方、Super Secreteでは、大腸菌を破砕する必要がないため、菌体由来の成分の混入の大幅な削減と精製工程の簡略化が可能となります。当社はラボレベルの少量スケール生産法(小型のジャーファーメンターを用いた培養と精製法)を確立しています。
これにより、初期の開発ステージにおける薬理学的試験(細胞アッセイ、動物試験)、安定性、毒性・安全性試験に必要な量のDRPを提供することが可能となりました。

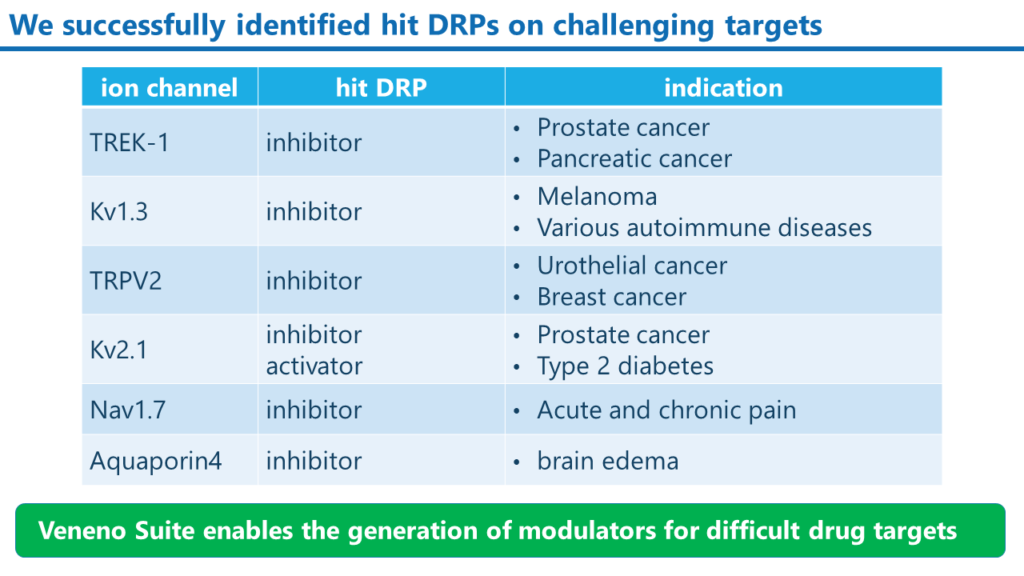
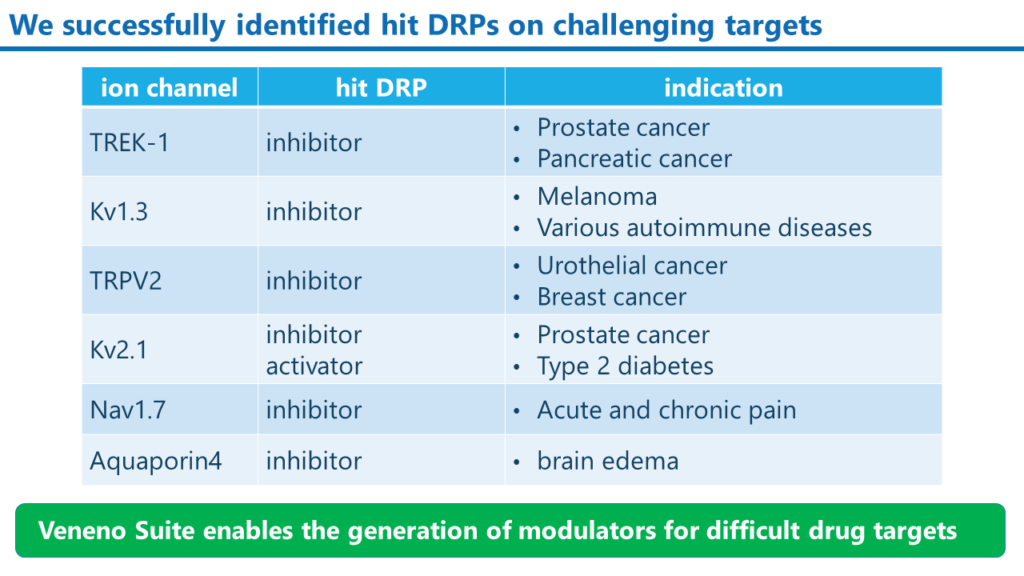
これまでに取得したモジュレーターDRPの例
Veneno Suiteによって、当社は種々のイオンチャンネルを標的分子とした阻害剤と活性化剤の創出に成功しています。
これまでに取得したモジュレーターDRPの例
Veneno Suiteによって、当社は種々のイオンチャンネルを標的分子とした阻害剤と活性化剤の創出に成功しています。


Veneno Technologies株式会社
〒305-0047 茨城県つくば市千現2丁目1番地6
info@veneno.jp